Tutustu ensimmäisenä tislauskolonnin rakenteeseen ja toimintaan.
Tee kolviin etanoli-vesiseosta määrä joka vastaa ⅔ kolvin tilavuudesta 250 ml denaturoitua etanolia litraa kohti.
Laske kolvissa olevan liukson etanolipitoisuus tilavuusprosentteina. (kanisterissa olevan industolin etanolipitoisuus on 90,5 t-%)
Tarkemman työselosteen löydät täältä
Tislaus on yksikköprosessi, jossa esim.kahden toisiinsa liukenevan nesteen seoksesta höyrystetään helpommin haihtuva komponentti ja syntynyt höyry erotetaan lauhduttamalla. Tislaus tehtiin kellopohjakolonnillaja tässä on kuva siitä.
Refraktometria on menetelmä jolla mitataan aineen taitekerrointa. Silla voidaan mitata esim. puhtautta ja koostumusta. Refraktometreillä voidaan nesteiden lisäksi mitata myös kaasuja ja kiinteitä aineita, kuten jalokiviä. Muista että prismoja ei saa pyyhkiä millään muulla paperilla tai materiaalilla kuin linssipaperilla, jotta prismaan ei tulisi naarmuja.
Tässä kuvassa on tislauksen yhteydessä otetut näytteet ja sen jälkeen tehdyt näytteet. Näytteistä on tairkoitus mitata taitekertoimet refraktometrilla. Janiiden avulla saadaan tietoon etanolipitoisuudet taulukostakatsomalla.
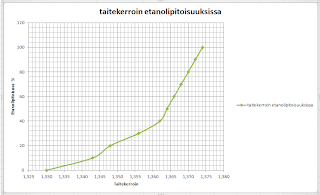
Tässä kuvassanäkyy tislauksen yhteydessä otettujen näytteiden taitekertoimet. Näytteiden etanolipitoisuus voidaan katsoa seuraavasta kuvaajasta kyseisten taitekertoimien kohdalta.
etanolipitoisuus 1 näyte 250 ml tisleestä on 100 %
etanolipitoisuus 2 näyte 250 ml tisleestä on 80 %
etanolipitoisuus 3 näyte 250 ml tisleestä on noin 65 %
Etanolipitoisuus a näyte 250ml kolvista on noin 21 %
Etanolipitoisuus b näyte 250ml kolvista on 20 %
Etanolipitoisuus c näyte 250ml kolvista on noin 13 %
Etanolipitoisuus 1a näyte150 ml tisleestä 90 %
Etanolipitoisuus 2a näyte150 ml tisleestä noin 65 %
Etanolipitoisuus3a näyte150 ml tisleestä noin 56 %
Etanolipitoisuus a1 näyte 150ml kolvista noin 13 %
Etanolipitoisuus b1 näyte 150ml kolvista noin 8 %
Etanolipitoisuus c1 näyte 150ml kolvista noin 5 %